Mecanismo epigenómico tratado: Metilación de ADN.
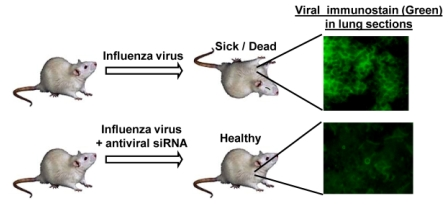
¿Cómo se lo hizo? Para probar el efecto de LSD1 sobre la actividad de IFITM3 hacia la infección por el virus, las células HEK293T fueron transfectadas con IFITM3 y LSD1. Después de dos días se dio un tratamiento con IFNα, que desencadena la desmetilación de IFITM3 por LSD1 para ser antiviral activo.
Resultados: Al contrario de su papel en la mejora de la replicación del virus de ADN, la histona desmtilasa LSD1 limita la replicación del virus de ARN al desmetilar y activar IFITM3, que es un factor de restricción del huésped para muchos virus de ARN. Hemos encontrado que LSD1 se recluta para desmetilar IFITM3 en la posición K88 bajo tratamiento con IFNα. Se sugiere que la desmetilación de IFITM3 por LSD1 es beneficiosa para el huésped para luchar contra la infección por el virus de ARN.
LSD1 cataliza la desmetilación de lisina de IFITM3 en K88
 |
| Imagen tomada con fines académicos de https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5760097/figure/ppat.1006773.g005/ |
Bibliografía:
1. Shan J., Zhao B., Shan Z., Nie J. Deng R., et al. Rui Xiong5Histone demethylase LSD1 restricts influenza A virus infection by erasing IFITM3-K88 monomethylation. n. PLoS Pathog [Internet]. 2017 [Citado el 12 dic 2020]; 13 (12): 1-22. Disponible en https://sci-hub.tw/https://www.ncbi.nlm.nih.gov/pubmed/29281729